§34. Применение рекомбинантных дезоксирибонуклеиновых кислот
Цель изучения этой темы: объяснить применение рекомбинантных дезоксирибонуклеиновых кислот.
Что такое генно-модифицированные организмы, трансгенные организмы и организмы с рекомбинантной ДНК? Есть ли принципиальная разница между данными понятиями?

Что нужно повторить для успешного изучения темы? Предыдущие параграфы.
Генная инженерия – новейшая область человеческих знаний, связанная с целенаправленным созданием и применением новых комбинаций генетического материала – рекомбинантных ДНК. Используя эти методы, также удаляют, т. е. «вырезают», нежелательные гены. Технически это даже проще, чем встраивать.
Перспективы генной инженерии огромны. Пока человечеству просто трудно их оценить, хотя результаты применения рекомбинантных ДНК уже играют важную роль в медицине и сельском хозяйстве. В медицине это в первую очередь применение генно-модифицированных бактерий кишечной палочки со встроенными генами инсулина человека и некоторых других гормонов. Применение такого рода исследований должно вестись с осторожностью. Прежде чем поступить в сельскохозяйственное или промышленное производство, полученные сорта, породы и штаммы должны проходить длительные контрольные испытания.
Культура бактериальных клеток, сочетающих ДНК разных организмов, продуцирует вещества, характерные для разных геномов. Собственные белки используются бактерией и позволяют ей нормально жить, функционировать и размножаться. А гены, например инсулина человека, позволяют осуществлять его биосинтез.
Многое о том, как работает сложная генетическая система в нашем организме и у других видов живых существ, еще предстоит узнать. Необходимо определить условия активации каждого гена. Для многоклеточных организмов важно выявить, в какие периоды жизни, в каких частях тела и при каких обстоятельствах он включается и приводит к синтезу соответствующего белка.
Промышленная микробиология сейчас стала широко использовать микроорганизмы с рекомбинантными ДНК. Оказалось, что генетическая инженерия еще более успешна в работе с микроорганизмами – бактерия ми, грибками (дрожжи, пеницилл) – и с одноклеточными водорослями, чем в работе с растениями и животными. Это существенно повысило продуктивность промышленных микроорганизмов – производителей классических продуктов – путем введения дополнительных генов, увеличения их количества или активности. Вводя в микробную клетку новые гены, удалось изменить питательные потребности микроорганизмов. Так были созданы микробы, помогающие утилизировать некоторые промышленные и бытовые отходы, часть из которых еще и производит полезные вещества (гумус, биогаз). Как уже отмечалось, микроорганизмы «научили» синтезировать несвойственные им вещества и таким образом увеличили разнообразие биотехнологической продукции за счет совершенно новых продуктов клонированных генов. Некоторые белки человека, клонированные в микробной клетке (инсулин, интерфероны, соматотропин, интерлейкины), находят сегодня повсеместное терапевтическое применение.
Трансгенные растения – это растения, которым «пересажены» гены других организмов.
К концу 1980-х годов путем внедрения новых генов удалось создать растения табака со светящимися листьями, томаты, легко переносящие заморозки, кукурузу, устойчивую к воздействию пестицидов. В целях получения растений, устойчивых к вирусам, в их клетки стали вводить гены белка оболочки вируса. Так были получены трансгенные растения, способные противостоять воздействию более десятка различных вирусных инфекций.
При защите растений от насекомых-вредителей применение инсектицидов не вполне эффективно, во-первых, из-за их токсичности, во-вторых, потому что инсектициды смываются с растений дождевой водой. Трансгенные же растения картофеля и томатов стали устойчивы к непобедимому до этого колорадскому жуку, а растения хлопчатника – к разным насекомым, в том числе к хлопковой совке.
Картофель, устойчивый к колорадскому жуку, был создан путем введения гена, выделенного из генома почвенной тюрингской бациллы, вырабатывающей особый белок. В кишечнике насекомых этот белок растворяется и активируется до истинного токсина, губительно действующего на личинок и имаго насекомых. У человека и других теплокровных животных подобная трансформация невозможна, и, соответственно, этот белок для человека нетоксичен и безопасен. Опрыскивание спорами этой бациллы использовалось для защиты растений и до получения первого трансгенного растения, но мера эта была недейственной. Сейчас существенно повысилась результативность защиты, а также экономическая эффективность, потому что растение само начало продуцировать защитный белок.
Список растений, к которым успешно применены методы генной инженерии, включает яблоню, сливу, виноград, капусту, баклажаны, огурцы, пшеницу, сою, рис, рожь и многие другие. От обычных они отличаются тем, что в их ДНК внедряются гены других растений или иных организмов. Трансгенные растения отличаются высокой урожайностью, они устойчивы к погодным условиям (жара, засуха, дожди) и действию пестицидов, которыми на полях уничтожают сорняки. Встраивая в ДНК растения тот или иной инородный ген, можно получить сорт с заранее заданными свойствами. Но ни один ученый не может с уверенностью сказать, повредит ли это людям, употребляющим в пищу такие растения. Ведь белки, входящие в состав генетически модифицированных продуктов, могут принадлежать как бактериям, так и несъедобным или ядовитым растениям. Они неизвестны нашему организму, и у него может не оказаться ферментов и механизмов их утилизации. Одни считают, что такие продукты не только безопасны, но и полезны, другие говорят о скрытой в них угрозе человеческому существованию. Трансгенные продукты не превратят людей в мутантов, но могут спровоцировать у потомков не встречавшиеся ранее нарушения. Хотя вопрос о безопасности трансгенных продуктов остается открытым, ряд стран объявил о моратории на их ввоз. В некоторых странах, например в России, существует запрет на их выращивание, в других – обязательна маркировка на этикетках о наличии генетически модифицированных компонентов в составе продуктов.
Трансгенные животные. В качестве объектов чаще всего используются свиньи. Японские генные инженеры ввели в геном свиней ген шпината, который производит фермент, способный преобразовывать жирные насыщенные кислоты в линолевую ненасыщенную жирную кислоту. У модифицированных свиней на 1/5 больше ненасыщенных жирных кислот, чем у обычных. Это впервые позволило получить «диетическую» свинину.
Другое направление работы – это генная модификация свиньи как донора человеческих органов. Группа исследователей из Национального университета Тайваня путем введения в ДНК эмбриона гена зеленого флуоресцентного белка, позаимствованного у флуоресцирующей медузы, вывела светящихся свиней, чтобы иметь возможность визуально наблюдать за развитием тканей при пересадке стволовых клеток.
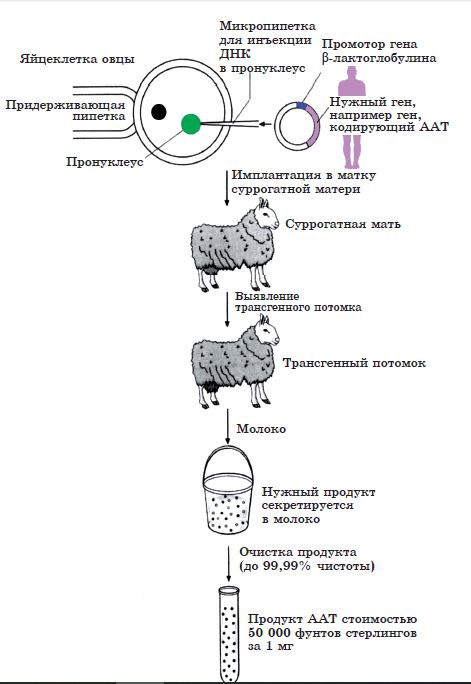
Также интересны модификации молочных пород животных с введенными в их геном генов, необходимых человеку (рис. 35).
Рис. 35. Генная модификация овцы
Примечание: ААТ (альфа-антитрипсин) – важный белок, вырабатываемый организмом человека и необходимый для успешной регенерации ряда органов (печень, легкие и др.) после болезни
За последние несколько десятилетий ученые создали методы, благодаря которым отдельные клетки тканей растения или животного можно заставить расти и размножаться отдельно от организма, как клетки бактерий. Такие культуры клеток используют для экспериментов и промышленного получения некоторых веществ, произвести которые с помощью бактериальных культур невозможно. Однако здесь есть свои трудности. Например, неспособность животных клеток делиться в культуре бесконечное число раз, как это происходит с бактериями. Кроме того, получать и выращивать культуры животных клеток труднее, чем бактериальные. На сегодня (пока!) не существует методов, обеспечивающих «выращивание» из культуры клеток животных не только целых полноценных организмов, но даже сложных органов, таких, например, как сердце, почки, легкие. Но наука не стоит на месте. Уже сейчас ученые обладают методиками выращивания из стволовых клеток хрусталика глаза, человеческого зуба или кожи, пригодной для пересадки. Это можно считать методами «клонирования» органов. Но такая методика для растений давно и хорошо отработана (практически с 60-х годов ХХ в.).
Генная инженерия, промышленная микробиология, трансгенные растения, трансгенные животные.

Знание и понимание
1. Объясните, необходимо ли длительно и тщательно испытывать «творения» генной инженерии, прежде чем запускать их в производство.
2. Как вы понимаете, для чего изобретают и применяют трансгенные растения?
Применение
1. Приведите примеры генетических модификаций бактериальных клеток, принесшие экологическую пользу.
2. Сравните, какие группы живых организмов в генной инженерии меньше всего подвергаются модификации. Назовите причины, по которым это происходит.
Анализ
1. Докажите на примерах, как генная инженерия бактерий помогает медицине (мира или Казахстана).
2. Выскажите ваше мнение о причинах, почему бактериальные клетки являются самыми используемыми организмами в трансгенной инженерии.
Синтез
1. Порассуждайте, почему трансгенная инженерия может быть опасна как для организма отдельного человека, так и для человечества как социального сообщества.
2. Смоделируйте ситуацию: «В ближайшем будущем благодаря генной инженерии станет возможно из клеток организма конкретных людей выращивать для них запасные органы».
Оценка
1. Обсудите следующие высказывания:
– Генная модификация организмов несет потенциальную угрозу человечеству. Ее последствия могут оказаться непредсказуемыми, а понимание масштабов угрозы может быть осознано слишком поздно.
– Благодаря использованию генно-модифицированных организмов человечество решит множество проблем, в том числе и проблему утилизации всех видов как хозяйственных, так и промышленных отходов.
2. Оцените экономические и экологические последствия применения генно-модифицированных, в том числе трансгенных организмов.